IVDR简介
IVD是“In Vitro Diagnostic MedicalDevice”的缩写,译为“体外诊断医疗器械”。
2017年5月5日欧盟体外诊断医疗器械法规(IVDR)正式发布,于2017 年5 月25日正式生效,并于2022 年5 月26 日实施。自实施之日起, IVDR 将取代原欧盟体外诊断设备指令(IVDD)。
与大部分国家一样,欧盟的监管体系也是呈“金字塔” 式的多层级法规体系: 在医疗领域, 法规层级从高到低依次为法规(Regulation)、指令(Directive)、决议(Decision)等,如图1 所示。
本次新发布的IVDR,在法规层级上从原先的Directive(指令)上升为Regulation(法规),标志着欧盟当局对医疗设备领域监管的进一步重视,同时也预示着在欧盟各成员国内医疗器械监管的尺度将得到进一步的统一。
分类规则的变化以及公告机构介入的增加
在IVDR法规中,对于体外诊断设备的监管依然是基于分类监管这个大框架,但是分类规则较原先的IVDD却发生了根本性的变化,即在IVDR中,基于产品的风险将所有的体外诊断设备由低到高分为了A、B、C、D四类,如图2 所示:
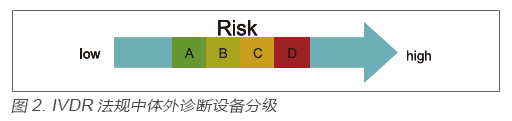
该分类规则来源于全球协调工作组(GHTF),目前加拿大、巴西、澳大利亚等国已使用,是国际范围内认可度较高的分类规则。各类产品举例见表1。

伴随着产品分类规则的调整,各类别产品对应的认证途径自然较原监管体系也有着很大的变化,其中最核心的变化点在于公告机构(Notified Body,NB)介入的增加,涉及产品包括所有的D、C、B类和部分A类。
在整个IVD领域,涉及公告机构介入的产品数量从IVDD监管体系下的10%~20%增加至80%~90%[2]。告机构介入量的增加,意味着绝大多数的体外诊断设备,在欧盟区的市场准入将要告别原先“自我宣称”的形式,取而代之的将是一个实质性的注册过程。
总结:
根据Regulation(EU) 2024-076中的定义:
体外诊断医疗器械”是指任何医疗器械包括试剂、试剂产品、校准品、质控品、试剂盒、仪器、器具、成件设备、软件或系统,无论是单独使用还是组合使用,其制造目的用于体外检测来自人体的血液和组织样本,仅用于或主要用于提供以下一类或几类信息:
关于生理或病理过程或状态;
关于先天性身体或精神损伤;
关于医学病症或疾病的倾向;
确定与潜在接受者的安全性和相容性;
预测治疗效果或反应;
定义或监测治疗措施。
样本容器应归为体外诊断医疗器械。
根据IVDR Regulation (EU) 2024-076附录VIII分类规则,分为四个等级:classA,class B,class C和class D。
| 分类条款 | 规则内容 |
| 规则1 | 用于以下用途的器械归类为D类:-检测血液、血液成分、细胞、组织或器官,或其任何衍生物是否存在或显露传染性因子,以评估它们是否适用于输血、器官移植或细胞给药。-检测是否存在或显露传染性因子,其会导致危及生命的疾病,并且具有高的或可疑的传播风险。-确定危及生命的疾病的病原体载量,其监控对于患者管理的过程十分关键。 |
| 规则2 | 器械预期用于血型分型或组织分型,以确保用于输血或移植或细胞给药的血液、血液成分、细胞、组织或器官具有免疫相容性,此类器械归类为C类,但用于确定以下任何标记物的器械除外:-ABO系统 [A(ABO1)、B(ABO2)、AB(ABO 3)];-恒河猴(Rhesus)系统 [RH1(D)、RHW1、RH2(C)、RH3(E)、RH4(c)、RH5(e)];-KELL系统 [Kel1(K)];-KIdd系统 [JK1(Jka)、JK2(Jkb)];-Duffy系统 [FY1(Fya)、FY2(Fyb)],在这种情况下,它们被归为D类。 |
| 规则3 | 器械被归为C类,若其目的是:(a)用于检测是否存在或显露性传播病原体的;(b)用于检测是否在脑脊液或血液中存在某种高的或可疑的高传播风险的病原体;(c)用于检测病原体的存在,其报告结果若错误可带来引起个人、胎儿、胚胎或个体的后代死亡或严重残疾的重大风险;(d)用于女性的产前筛查,确定其对感染原的免疫状况;(e)用于确定感染性疾病的状态或免疫状态,若其报告结果将会引起患者治疗决定导致危及患者或患者后代生命的风险;(f)用作伴随诊断;(g)用于疾病分期,若其报告结果错误将会引起患者治疗决定导致危及患者或患者后代生命风险的;(h)用于癌症的筛查、诊断或分期;(i)人类基因检测;(j)用于检测药用产品、物质或生物组分的水平,若其报告结果错误将会引起患者治疗决定导致危及患者后代生命的风险;(k)对危及生命的疾病或病症患者,进行患者管理;(l)用于筛查胚胎或胎儿的先天性疾病;(m)用于新生儿的先天性疾病筛查,未能检测和治疗这些疾病可能导致危及生命的情况或严重残疾。 |
| 规则4 | (a)自测器械归为C类,但用于妊娠检测、生育力测试、确定胆固醇浓度以及检测葡萄糖、红细胞、白细胞和尿样本中细菌的器械除外,这些器械归为B类。(b)床旁检测器械根据其本身特性进行分类。 |
| 规则5 | 以下器械归为A类:(a)一般实验室使用的产品、没有危险特征的附件、缓冲液、洗涤液、一般培养基和组织学染色液,制造商使其适用于相关某一特定检查的体外诊断流程;(b)制造商专门用于体外诊断流程的器械;(c)样品容器。 |
| 规则6 | 上述分类规则未涵盖的器械归类为B类。 |
| 规则7 | 不具有定量或定性赋值的质控品的器械归类为B类。 |
欧盟医疗器械数据库的建立以及监管透明度的增加
在欧盟过去十多年的医疗器械监管中,监管的透明度一直是业内诟病比较多的一点。究其原因主要在于没有一个公开的数据库供各方查询[3]。在IVDR的法规体系下,欧盟主管当局一个很重要的工作就是未来将要推出医疗器械数据库(Eudamed),该数据库涵盖从产品上市前审批到上市后监管中的很多重要信息。见图3:
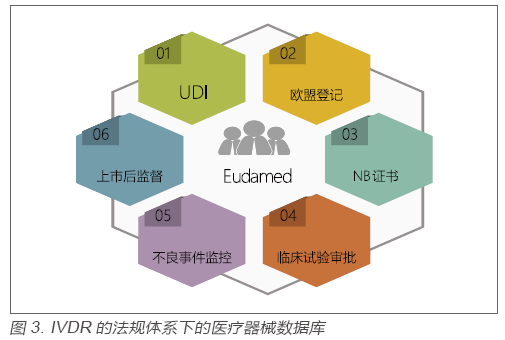
在IVDR中还提出了安全和性能摘要(Summary of Safety and Performance)的要求,以进一步增加监管的透明度。该要求包括C类和D类的产品需要以摘要的形式,将产品规格、性能评估结论及临床试验结论等信息公开。通过该摘要,一方面使用者可以更清楚地了解产品的性能指标,另一方面生产企业可以更加详细地对比同类产品的监管尺度[4]。
唯一设备识别系统(Unique Device Identification System, UDI)的引入
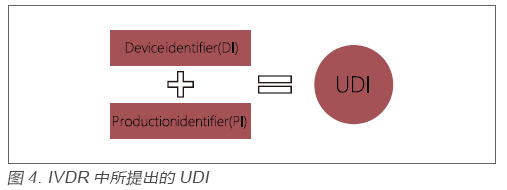
继美国FDA实施UDI的要求以来,世界范围内纷纷效仿,很多国家相继推出相关草案。欧盟本次出台的IVDR,同样也引入UDI的要求,以增强产品的追溯以及上市后的管理。与FDA的要求一样,IVDR中所提出的UDI同样是由一个固定的产品识别码(Device Identifier,DI)和一个非固定的生产识别码(Production Identifier,PI)组成,见图4。生产企业在实施UDI的过程中,需要明确各产品的UDI代码及所包含的信息,并在产品上加贴UDI标贴,同时以电子形式存储UDI相关信息并在Eudamed系统上申报。
法规负责人的提出
IVDR法规中,首次提出了法规负责人的要求:要求每个制造商企业内,至少任命一位法规负责人,负责处理与产品相关的监管、合规性相关工作。具体的职责包括产品批放行、起草和维护CE技术文档、完成上市后产品的监控、临床试验相关文件的签署等。
提出法规负责人的要求,标志着新法规IVDR对于执行层面的思考;意味着法规要求在企业内的责任明确、落实到人,从生产企业内部促进着产品的安全性和有效性[5]。
过渡期与法规切换
新法规IVDR与IVDD相比变化很大,为避免由于法规切换而造成对现有医疗系统的冲击,实现法规的“软着陆”,IVDR法规从生效(Entry *** Force)到实施(Application)期间有5年的过渡期。IVDR法规的生效日为2017年5月25日,实施日为2022年5月26日。在生效日前依照旧法规IVDD颁发的CE证书,在证书有效期内持续有效;在生效日后依照旧法规IVDD颁发的CE证书,在实施日后的2 年失效(若证书有效期晚于该时间点)。见图5。
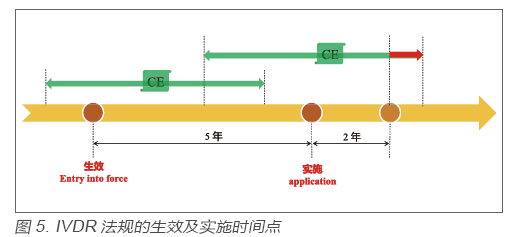
所以,在IVDD法规框架下“自我宣称”类的产品,由于不涉及CE证书,故需要在实施日前完成IVDR法规的切换;少部分在IVDD法规框架下涉及CE证书的产品,需要在证书有效期内完成IVDR法规的切换,但不得晚于实施之后的2 年。
结语
欧盟作为全球重要的医械市场之一,我们有必要满足IVDR法规的要求。与全球市场同步进行实时追踪及实施工作。
具体的方案请您联络我们的工程师,即便您不和我们合作,我们也可以给您提供专业的参考建议。




















